در این بخش برخی از تعاریف و مفاهیم اولیه شیمی ارائه میگردد:
تعریف واکنش شیمیایی:
واکنش شیمیایی (Chemical Reaction) فرآیندی است که یک یا چند مولکول یا اتم با یکدیگر تعامل میکنند که طی این واکنش مواد اولیه شرکتکننده در واکنش تغییر میکنند و به یک یا چند ماده شیمیایی تبدیل میشوند. این تعاملها ممکن است شامل تغییرات در اتمها، پیوندهای شیمیایی، انتقال الکترون، پروتون یا یون، تغییرات حالت فیزیکی مولکولها و… باشد. در ادامه با طرفهای واکنشدهنده و فرآورده (محصول) یک واکنش شیمیایی و همچنین فرآیند موازنه واکنش شیمیایی آشنا خواهید شد.
معادله شیمیایی:
وقتی یک واکنش شیمیایی انجام میشود آن را به صورت یک معادله نشان میدهند که دارای واکنشدهندهها و فرآوردهها (محصولات) است. یک معادله کامل معادلهای است که موازنه شده است و ماهیت مواد در آن مشخص شده است. اگر واکنش غیر برگشتپذیر باشد، از یک فلش تنها به سمت راست و در صورت برگشت پذیر بودن واکنش از دو فلش (در جهات مخالف هم) استفاده میشود.
واکنش دهنده و فرآورده:
در یک واکنش شیمیایی دو طرف، واکنشدهنده و محصول وجود دارد. به عبارت دیگر سمت چپ واکنش ماده هایی وجود دارد که همان موادی اند که ابتدای واکنش حضور دارند و به واکنش شیمیایی با هم میپردازند و به آن واکنشدهنده (Reactant= R) میگویند که در نتیجه هر واکنش شیمیایی، در سمت راست آنچه که نمایش داده میشود شامل موادی است که آن را فرآورده (Product= P) یا محصول یک واکنش شیمیایی مینامند.
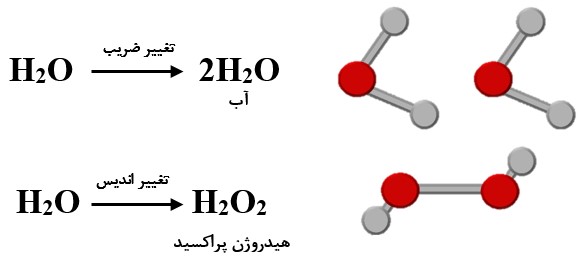
موازنه واکنش شیمیایی:
انتخاب ضرایب مناسب برای مواد دو طرف واکنش را موازنه کردن واکنش میگویند، به عبارت دیگر موازنه بدین معنی است که تعداد اتمهای مربوط به هر عنصر در دو سمت یک معادله واکنش شیمیایی با هم برابر باشند. موازنه در واقع بیانگر قانون پایستگی جرم میباشد که نشان میدهد وقتی یک واکنش شیمیایی رخ میدهد منجر به از بین رفتن مواد نمیشود؛ بلکه طی یک واکنش مواد تغییر کرده و یا حالت آنها عوض میشود. نکتهای که در انجام موازنه معادله شیمیایی ضروری است این است که توجه داشته باشید موازنه کردن نباید منجر به تغییر پیوند عناصر شود. به عبارت دیگر اگر اندیسهای یک عنصر را تغییر دهید در حقیقت پیوندهای آن را تغییر داده اید که در نهایت نوع مولکول تغییر میکند.
نمایش ماهیت مواد شیمیایی:
در یک معاله شیمیایی میتوان ماهیت واکنش دهندهها و محصولات را با اختصار این صورت نشان داد:
جامد (Solid): s، مایع (Aquatic): aq، گاز (Gas): g
در علم شیمی واکنشها به سه دسته کلی تقسیم میشوند که تمامی واکنشها یکی از این سه نوع میباشند:
واکنش رسوبی چیست؟
فرآیندی است که در آن واکنش دهندههای انحلال پذیر محصول جامد انحلال ناپذیر تولید میکنند به عبارت دیگر از مخلوط شدن دو محلول، ذرات حل نشده (رسوب) در محلول دیده میشود. با تشکیل این محصول پایدار، ماده از محلول آبی خارج میشود و نیروی محرکه واکنش تامین میگردد. اغلب واکنشهای رسوب دادن وقتی رخ میدهند که آنیونها و کاتیونها دو ترکیب یونی، یون مزدوج خود را تعویض میکنند.
محلول + محلول ← محلول + رسوب
واکنش خنثی شدن اسید- باز چیست؟
فرآیندی است که در آن یک اسید با یک باز واکنش میهد تا آب ترکیب یونی به نام نمک به دست دهد. اسیدها را به صورت ترکیباتی هستند که وقتی در آب حل میشوند یونهای H+ تولید میکنند و بازها نیز به صورت ترکیباتی هستند که وقتی در آب حل میشوند یونهای OH– به دست میدهند. از این رو نیروی محرکه واکنش خنثی شدن تولید مولکول کوالانسی پایدار آب با خارج شدن یونهای H+ و OH– از محلول است. به عنوان مثال واکنش بین هیدروکلریک اسید و سدیم هیدروکسید آبی که منجر به تشکیل آّب سدیم کلرید آبی میشود به عنوان یک مثال واکنش خنثی شدن اسید- باز در اینجا آمده است:
HCl (aq) + NaOH (aq) → H2O (I) + NaCl (aq)
واکنش اکسایش- کاهش (کاکس یا ردوکس) چیست؟
فرآیندی است که در آن یک یا چند الکترون بین اجزای واکنش (اتم ها، مولکول ها یا یون ها) مبادله میشوند. نیروی محرکه، کاهش پتانسیل الکتریکی است؛ درست مانند پدیدهای که هنگام به زمین افتادن یک سیم برق دار رخ میدهد و الکترونها از طریق سیم به زمین منتقل میشوند. نتیجه تبادل شدن این الکترونها تغییر بار بر روی اتمهای موجود در واکنش دهندههای مختلف است. مثال این واکنش، واکنش بین منیزیم فلزی با بخار ید است که اتم منیزیم یک الکترون به هر یک از دو اتم ید میدهد در نتیجه یک یون +Mg2 و دو یون I- تشکیل میشود و نهایتا بار Mg از 0 به 2+ و بار هر اتم I از صفر به 1- تغییر میکند:
Mg (s) + I2 (g) → MgI2 (s)





