در شیمی، واکنشهای شیمیایی به سه دسته کلی تقسیم میشوند: واکنشهای رسوبی، واکنشهای ردوکس و واکنشهای اسید و باز. هر یک از این دستهها نقش مهمی در فرآیندهای شیمیایی و بیولوژیکی دارند. در این مقاله، به بررسی واکنشهای اسید و باز خواهیم پرداخت که یکی از مهمترین و پرکاربردترین دستههای واکنشهای شیمیایی هستند.
تعریف واکنشهای اسید و باز
واکنشهای اسید و باز نوعی از واکنشهای شیمیایی هستند که در آنها یک اسید و یک باز با هم واکنش داده و محصولات جدیدی را تشکیل میدهند. این واکنشها نقش مهمی در بسیاری از فرآیندهای صنعتی، بیولوژیکی و محیطی دارند. اسیدها و بازها به عنوان دو نوع ماده شیمیایی با ویژگیهای متضاد، تعاملات جالبی با یکدیگر دارند که منجر به تشکیل نمکها و آب میشود.
تعریف اسید و باز بر اساس نظریههای مختلف
در طول تاریخ، دانشمندان مختلفی نظریههایی را برای توضیح واکنشهای اسید و باز پیشنهاد دادهاند. مهمترین این نظریهها عبارتند از:
نظریه آرنیوس
نظریه آرنیوس یکی از اولین و سادهترین نظریههای اسید و باز است. بر اساس این نظریه:
- اسید مادهای است که در آب هیدروژن یون (+H) آزاد میکند.
- باز مادهای است که در آب هیدروکسید یون (–OH) آزاد میکند.
نظریه برونستد لوری
نظریه برونستد-لوری که توسط یوهانس برونستد و توماس لوری توسعه داده شد، تعریفی گستردهتر از اسیدها و بازها ارائه میدهد:
- اسید دهنده پروتون (+H) است.
- باز گیرنده پروتون (+H) است.
این نظریه تعاملات اسید و باز را در محیطهای غیرآبی نیز توضیح میدهد و کاربرد بیشتری دارد.
نظریه لوییس
نظریه لوییس، که توسط گیلبرت لوییس ارائه شد، اسیدها و بازها را بر اساس انتقال الکترون تعریف میکند:
- اسید پذیرنده جفت الکترون است.
- باز دهنده جفت الکترون است.
این نظریه تعاملات اسید و باز را به خوبی در واکنشهای پیچیدهتری که شامل انتقال الکترون هستند، توضیح میدهد.
واکنشهای اسید و باز در محیطهای مختلف
واکنشهای اسید و باز میتوانند در محیطهای آبی و غیرآبی رخ دهند. در محیطهای آبی، واکنشهای اسید و باز به طور معمول منجر به تشکیل آب و یک نمک میشوند. برای مثال:
HCl + NaOH → NaCl + H2O
در این واکنش، اسید هیدروکلریک (HCl) با باز هیدروکسید سدیم (NaOH) واکنش داده و نمک کلرید سدیم (NaCl) و آب (H₂O) تولید میشود.
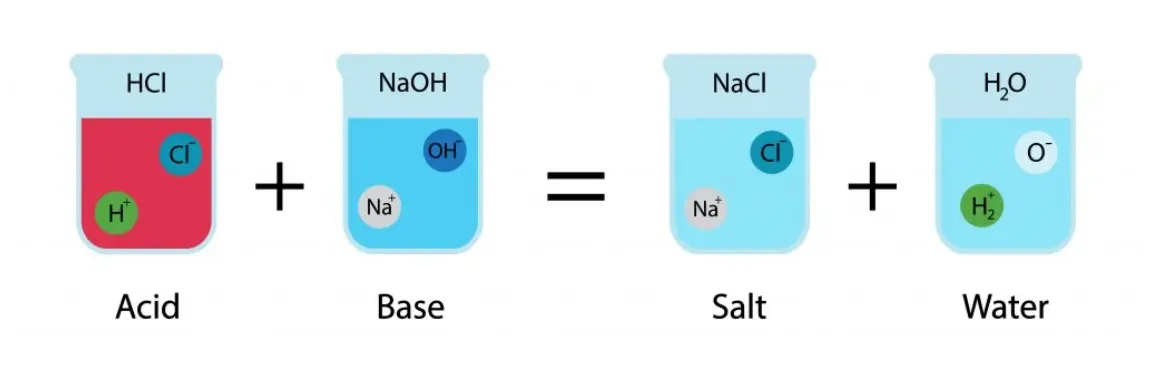
واکنش بین اسید و باز
کاربردهای واکنشهای اسید و باز
واکنشهای اسید و باز در بسیاری از فرآیندهای صنعتی و روزمره کاربرد دارند. برخی از مهمترین کاربردهای این واکنشها عبارتند از:
تنظیم pH
یکی از مهمترین کاربردهای واکنشهای اسید و باز، تنظیم pH محلولها در صنایع مختلف است. pH میزان اسیدی یا بازی بودن یک محلول را نشان میدهد و در بسیاری از فرآیندهای شیمیایی و بیولوژیکی کنترل pH ضروری است.
تولید نمکها
واکنشهای اسید و باز برای تولید نمکها که در صنایع مختلف کاربرد دارند، استفاده میشوند. نمکها محصولات واکنشهای اسید و باز هستند و میتوانند در تولید مواد شوینده، صنایع غذایی و داروسازی مورد استفاده قرار گیرند.
بازیافت فلزات
در صنایع معدنی و متالورژی، واکنشهای اسید و باز برای استخراج و بازیافت فلزات از سنگهای معدنی استفاده میشوند. این واکنشها به جدا کردن فلزات از ترکیبات ناخواسته کمک میکنند.
سیستمهای بافری
سیستمهای بافری که توانایی حفظ pH ثابت را دارند، از واکنشهای اسید و باز تشکیل میشوند. این سیستمها در فرآیندهای بیولوژیکی و صنایع شیمیایی برای جلوگیری از تغییرات ناگهانی pH استفاده میشوند.
مثالهای کاربردی واکنشهای اسید و باز
فرآیند خنثیسازی در تصفیه آب
در تصفیه آب، یکی از مراحل مهم خنثیسازی است که در آن اسیدها و بازهای موجود در آب خنثی میشوند تا pH آب تنظیم شود. این فرآیند به بهبود کیفیت آب و جلوگیری از خوردگی لولهها کمک میکند.
فرآیندهای بیولوژیکی
در بدن انسان و سایر موجودات زنده، واکنشهای اسید و باز نقش حیاتی دارند. برای مثال، سیستم بافری خون که شامل کربنیک اسید (H₂CO₃) و بیکربنات (–HCO₃) است، به حفظ pH خون در محدودهای مناسب کمک میکند.
بررسی دقیقتر واکنشهای اسید و باز
واکنشهای اسید باز آرنیوس
این واکنشها شامل ترکیب یک اسید و یک باز آرنیوس برای تولید آب و نمک هستند. واکنشهای خنثیسازی کلاسیک مثالهای خوبی از این نوع واکنشها هستند.
واکنشهای اسید باز برونستد لوری
این واکنشها شامل انتقال پروتون بین اسید و باز هستند. یک مثال کلاسیک از این واکنشها، واکنش بین آمونیاک (NH₃) و آب است:
NH3 + H2O → NH4+ + OH–
در این واکنش، آمونیاک به عنوان باز و آب به عنوان اسید عمل میکنند.
واکنشهای اسید باز لوییس
این واکنشها شامل انتقال جفت الکترون بین اسید و باز هستند. یک مثال از این نوع واکنش، واکنش بین بور تریفلوئورید (BF₃) و آمونیاک است:
BF3 + NH3 → F3B:NH3
در این واکنش، BF₃ به عنوان اسید لوییس و NH₃ به عنوان باز لوییس عمل میکنند.
نتیجهگیری
واکنشهای اسید و باز یکی از مهمترین دستههای واکنشهای شیمیایی هستند که در بسیاری از فرآیندهای صنعتی، بیولوژیکی و محیطی نقش حیاتی دارند. این واکنشها بر اساس نظریههای مختلفی تعریف و توصیف شدهاند که هر کدام کاربردها و موارد استفاده خاص خود را دارند. با توجه به اهمیت بالای این واکنشها، درک عمیقتر از مکانیزمها و کاربردهای آنها میتواند به بهبود فرآیندهای شیمیایی و بیولوژیکی کمک کند.
برای آشنایی بیشتر با اسید و باز و شناسایی آنها کیت “شناساگرها و واکنش اسید و باز” پیشنهاد میگردد.
منابع
- سیلبربرگ، مارتین. (۲۰۱۵). شیمی عمومی. ترجمه حسین بنی عقیل. تهران: انتشارات دانشگاه تهران.
- مک موری، جان. (۲۰۱۶). شیمی عمومی: اصول و واکنشها. ترجمه عیسی یاوری. تهران: انتشارات دانشگاه صنعتی شریف.
تهیه تنظیم:
مهسا سبزی خباز